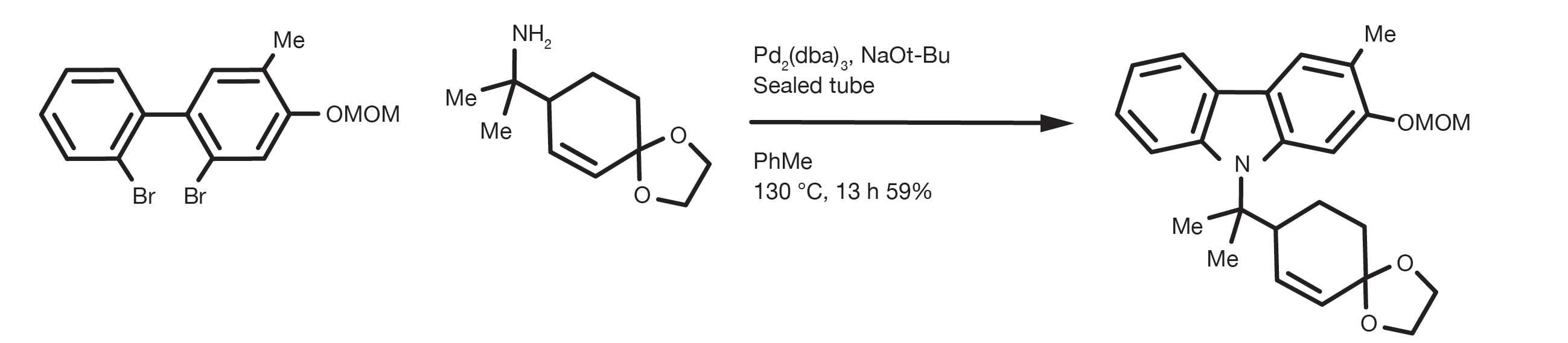
Aminierung
Amine sind unglaublich nützliche Zwischenprodukte und stellen eine Schlüsselfunktionalität der meisten biologisch aktiven Moleküle dar.
In der modernen organischen Synthesepraxis sind die häufigsten Reaktionen zur Bildung von C-N-Bindungen neben der Synthese von Amiden die nucleophile Substitution von Alkylhalogeniden und die Buchwald-Hartwig-Aminierung von Arylhalogeniden. Eine weitere ist die reduktive Aminierung von Carbonylverbindungen, die in diesem Artikel nicht behandelt wird.
Aminierung von Alkylhalogeniden
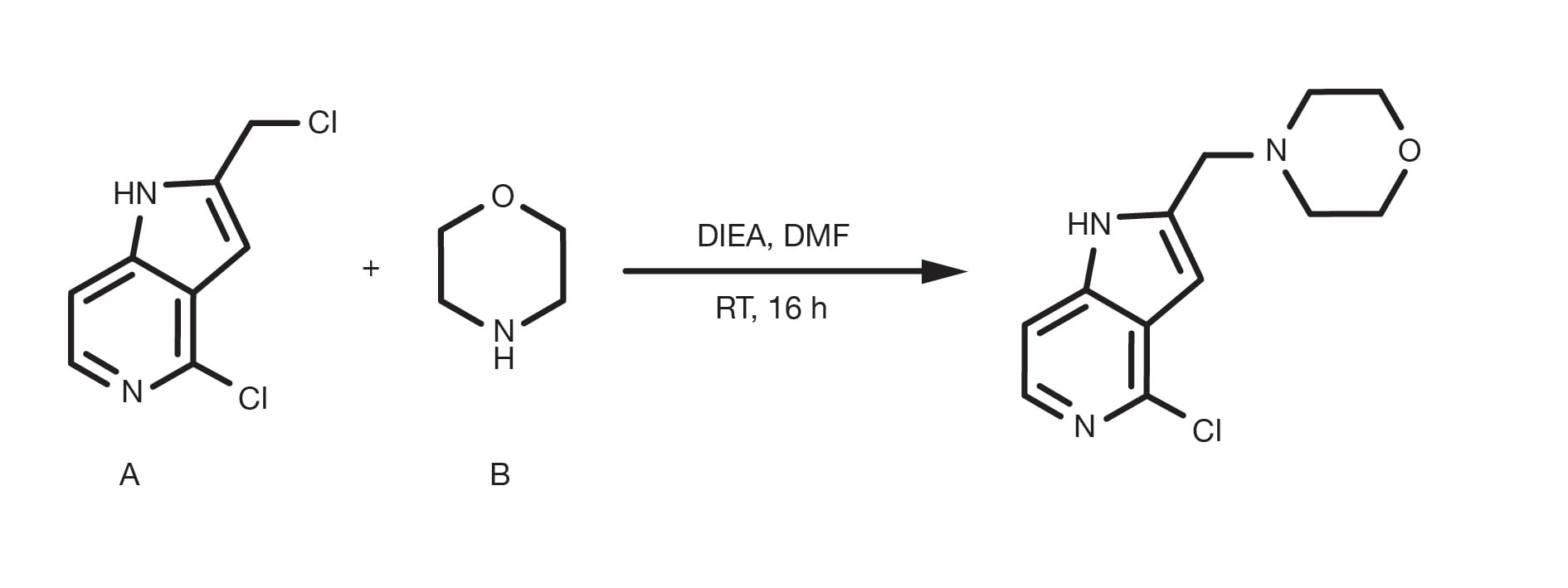
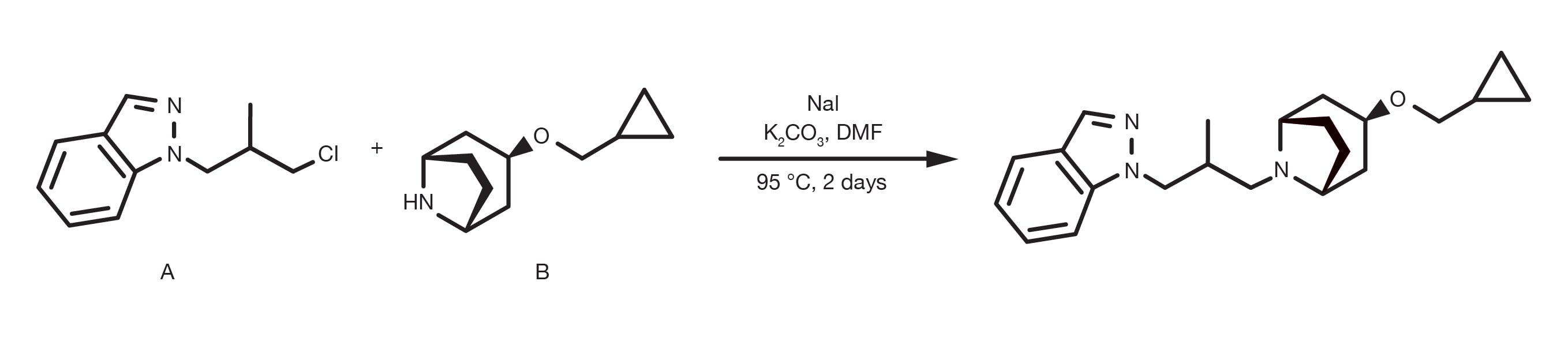
Oft als Alkylierung von Aminen bezeichnet, ist die nucleophile Substitution von Alkylhalogeniden mit aliphatischen oder heteroaromatischen Aminen eine „historische“ organische Reaktion. Sie ist eine relativ einfache, gut etablierte Reaktion und immer noch eine primäre Methode zur Alkylierung von Aminen mit aliphatischen Verbindungen.
Die aromatische nucleophile Substitution wurde hingegen zugunsten milderer, robusterer und effizienterer katalytischer Verfahren, insbesondere der Hartwig-Buchwald C-N-Kopplung, fast vollständig aufgegeben.
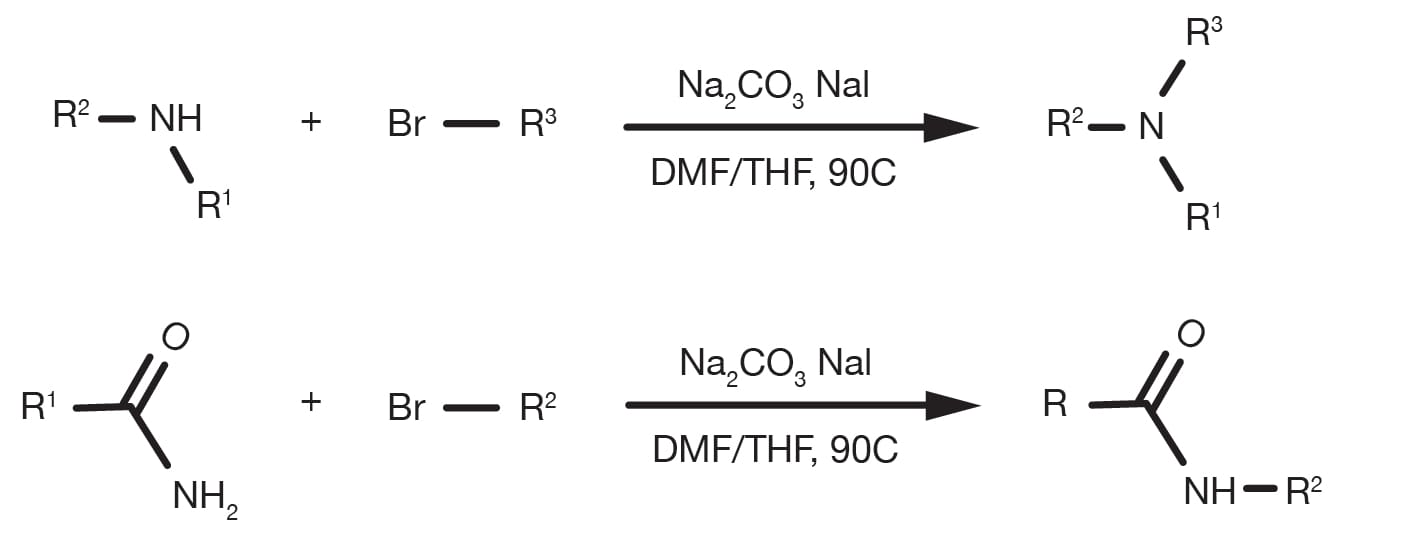
Die Aminierung von Alkylhalogeniden kann in mehreren verschiedenen Lösungsmitteln durchgeführt werden, wobei DMF und THF die gängigsten sind und in Gegenwart einer Base, wie beispielsweise Natriumcarbonat oder tertiärer Amine erfolgen. Die Temperatur ist ein Schlüsselparameter, um die Reaktionskinetik zu beeinflussen, und während die Substitution bei Raumtemperatur stattfinden kann, werden für weniger reaktive Bausteine weitgehend Refluxbedingungen berichtet. Die Alkylierung von heteroaromatischen Aminen erfordert oft den Einsatz von starken Basen, wie z. B. Natrium-bis(trimethylsilyl)amid und kryogenen Bedingungen.
Die Akylierungsrate folgt der Ordnung primäres Amin > sekundäres Amin > tertiäres Amin und die Reaktivität des Halogenidderivats folgt der Elektronegativität des Halogenidsubstituenten. Bromid und Iodid sind die praktischsten Bausteine, während Chloride aufgrund ihrer breiten kommerziellen Verfügbarkeit relativ verbreitet sind. Die Verwendung von Natriumiodid ist ein praktischer Weg, um in-situ ein reaktionsfähigeres Alkyliodid zu generieren, wenn das Ausgangsmaterial ein anderes Halogenid ist.
Die nucleophile Substitution von Alkylhalogeniden gilt nicht als eine sehr grüne Reaktion, da sie ein Halogenidionen-Nebenprodukt erzeugt. Bei großtechnischen industriellen Verfahren zur Herstellung einfacher Amine wird in der Regel die Aminierung von Alkoholen bevorzugt, da das Nebenprodukt Wasser ist. Dennoch bleibt es ein unverzichtbares Werkzeug in der synthetische organische Chemie.
Referenz-Reaktionsprotokolle
Bereiten Sie eine Lösung des Amins und des Alkylhalogenids in DMF vor. Die Verwendung eines Überschusses von beiden Ausgangsmaterialien ist vorteilhaft (1,5-2 Äquivalente). Fügen Sie 1,5 Äquivalente der Base hinzu und, falls das Halogenid ein Bromid oder ein Chlorid ist, 1,5 Äquivalente Natriumiodid. Bei Raumtemperatur 12-24 Stunden lang rühren. Für Bausteine mit geringerer Reaktivität ist eine Temperaturerhöhung bis hin zu Refluxbedingungen erforderlich. Am Ende der Reaktion wird mit Wasser gequencht, mit einem geeigneten organischen Lösungsmittel (z. B. Ethylacetat) extrahiert und die Produktreinigung durchgeführt.
Produktauswahl
Lösungsmittel:
SEHEN SIE ALLE UNSERE LÖSUNGSMITTEL – ÜBER 1.000 ALTERNATIVEN
Grundzutaten/Zusatzstoffe:
1,8-Diazabicyclo[5.4.0]undec-7-en (DBU)
Natrium-bis(trimethylsilyl)amid-Lösung
Sodium-bis(trimethylsilyl)amid, fest
VERWENDEN SIE DIE SUCHLEISTE OBEN AUF DER SEITE FÜR EINE GEZIELTE SUCHE NACH DEM PRODUKTNAMEN ODER DER CAS-NUMMER
Bausteine:
VERWENDEN SIE DIE SUCHFUNKTION FÜR CHEMISCHE STRUKTUREN, UM DEN GEWÜNSCHTEN BAUSTEIN ZU FINDEN
Verschieden substituierte Alkylbromide:
Verschieden substituierte Alkylchloride:
Verschieden substituierte Alkyliodide:
Nukleophile:
C-N-Kupplung
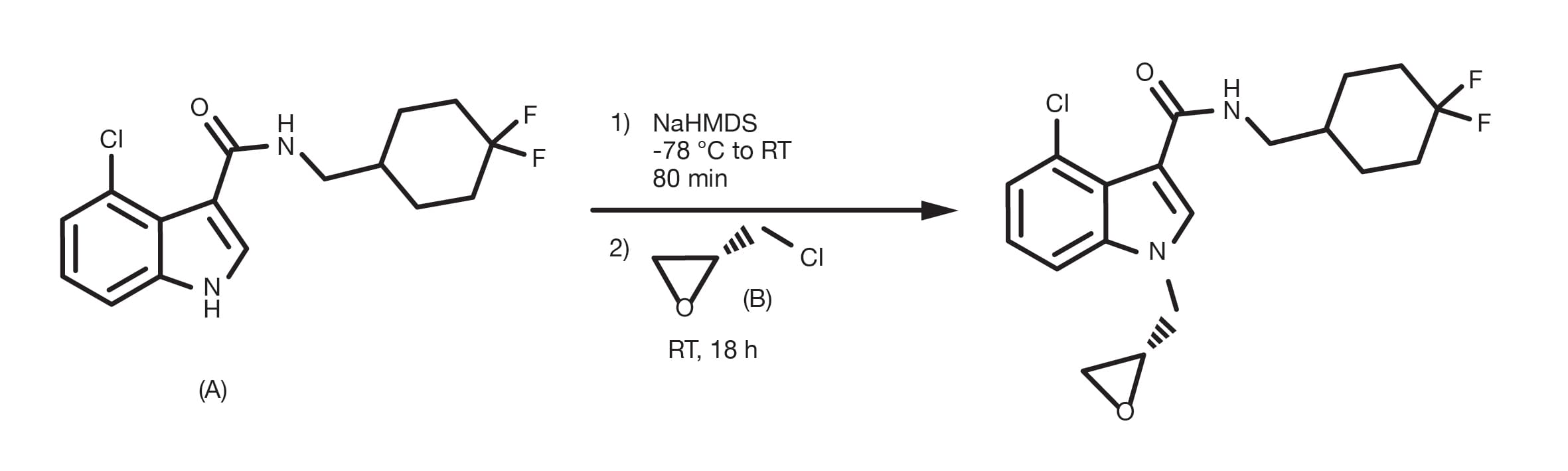
Obwohl bereits in den 1980er Jahren über die ersten C-N-Kupplungen berichtet wurde, hat erst die Arbeit der Professoren Buchwald und Hartwig von 1994 bis in die letzten Jahre dazu geführt, dass die Pd-katalysierte Kupplung zur Methode der Wahl für die Synthese aromatischer Amine geworden ist. Die Verwendung von milden Reaktionsbedingungen und eine neue Generation von luftstabilen, sehr aktiven Katalysatoren haben härtere Methoden, wie die nucleophile aromatische Substitution, verdrängt und gleichzeitig den Substratumfang der Transformation erweitert.
Die Arbeit von Professor Buchwald gehört konsequent zu den meistzitierten in der chemischen Literatur und die Buchwald-Hartwig-C-N-Kupplung ist eine der allgegenwärtigsten Reaktionen in der modernen organischen Synthese, ein wichtiger Schritt bei der Herstellung vieler biologisch aktiver Verbindungen von kommerziellem Interesse.
Die Reaktion ermöglicht die Pd-katalysierte Kupplung von nahezu jedem Amin mit unterschiedlich substituierten aromatischen/heteroaromatischen Halogeniden oder Triflate. Die Reaktion erfolgt in Gegenwart einer Base und kann in vielen verschiedenen Lösungsmitteln durchgeführt werden, mit Toluol, THF, Dioxan und DME, die am gängisten sind. Auch Alkohole, wie z. B. tert-Butanol oder tert-Amyl-Alkohol (besser bei hohen Temperaturen) sind gute Optionen.
Eine typische C-N-Kupplung wird bei 50-100 °C für bis zu 24 Stunden durchgeführt, obwohl häufig vollständige Konvertierungen in nur wenigen Stunden gemeldet werden.
Die vielseitigste Base für diese Reaktion ist wohl Natriumbutyrat. Allerdings ist es häufig notwendig, auf schwächere Basen zurückzugreifen, um Nebenreaktionen mit elektrophilen funktionellen Gruppen oder die Epimerisierung von sauren Kohlenstoffen zu vermeiden.
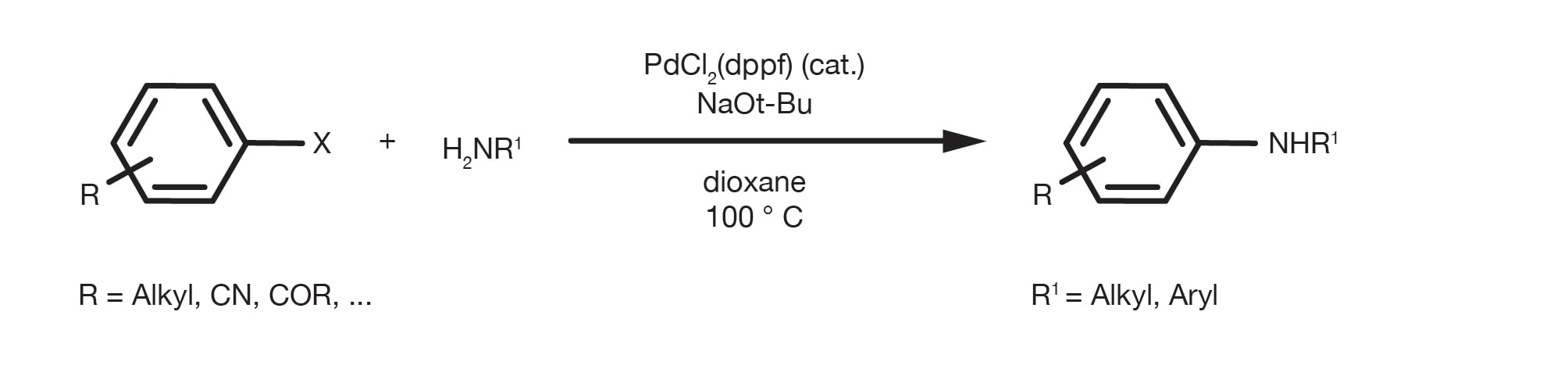
Die Kombination aus der Quelle von Pd(0) und Ligand ist der wichtigste praktische Parameter für eine erfolgreiche C-N-Kupplung. Es gibt viele Optionen für die Transformation, von Metallvorläufern und Liganden der alten Generation, wie z. B. Palladiumacetat und BINAP, oder dppf(1,1'-Bis(diphenylphosphino)ferrocen), bis hin zu vorgeformten Katalysatoren der modernen Generation, wie z. B. Generation-4 Pallade-Zyklen oder Pi-Allyl-Pd-Komplexen. Im Laufe der Jahre hat der Einsatz von elektronenreichen chelatbildenden Phosphinen wie Josiphos und Trialkylphosphinen den Substratumfang erweitert und die Reaktionsbedingungen entspannt. Von den vielen verfügbaren katalytischen Optionen haben jedoch nur wenige umfangreiche praktische Anwendungen gefunden. Die Schlüsselparameter für die Auswahl des Katalysators sind eine Kombination aus Benutzerfreundlichkeit (z. B. Luftstabilität), Robustheit, Substratumfang und kommerzieller Verfügbarkeit. Katalysatoren der modernen Generation, die auf voluminösen Dialkylbiarylphosphin-Liganden basieren, die von Buchwald und Hartwigs Forschung entwickelt wurden, bieten dank ihrer Luftstabilität und ihrer außergewöhnlichen Aktivität mehrere Vorteile und haben den Umfang der Reaktion enorm erweitert. Sie stellen heute die am häufigsten verwendeten Liganden in C-N-Kupplungsreaktionen dar.
Referenz-Reaktionsprotokolle
Eine unglaublich nützliche praktische Anleitung zur Identifizierung der besten Reaktionsbedingungen für eine Buchwald-C-N-Kupplung finden Sie in Chem. Sci., 2011, 2, 27 (DOI: 10.1039/c0sc00331j). Ein Referenzprotokoll lautet wie folgt:
Herstellen einer Toluollösung mit dem Arylhalogenid und dem Amin in äquimolaren Mengen, dem Pd-Katalysator (oder dem Pd-Vorläufer und dem Ligandengemisch) und 2 Äquivalenten Base (Cäsiumcarbonat oder Natrium-tert-Butanoat). Ein guter Ausgangspunkt für die Screening-Bedingungen ist der Einsatz einer 5-10 %igen Katalysatorbeladung, die mit einigen Optimierungsarbeiten später reduziert werden kann. Die Reaktion wird unter Rühren bei Temperaturen zwischen 90 und 140 °C, vorzugsweise unter Stickstoffatmosphäre (zwingend erforderlich bei nicht luftstabilen Katalysatoren) durchgeführt. Die Konvertierungszeiten können sehr kurz sein, auch unter 1 Stunde, obwohl häufig Reaktionszeiten von 12-24 Stunden gemeldet werden.
Der Einsatz eines Katalysators der neuesten Generation macht den Aufbau der Reaktion besonders einfach, da luftstabile Pd-Komplexe ohne Trockenschrank verwendet werden können und die Reaktion in normalen Laborglaswaren durchgeführt wird. Katalysatoren der vorherigen Generation und insbesondere die Verwendung aktiver Pd(0)-Spezies erfordern einige Vorsichtsmaßnahmen, die über den Rahmen dieses Textes hinausgehen.
Beispiele
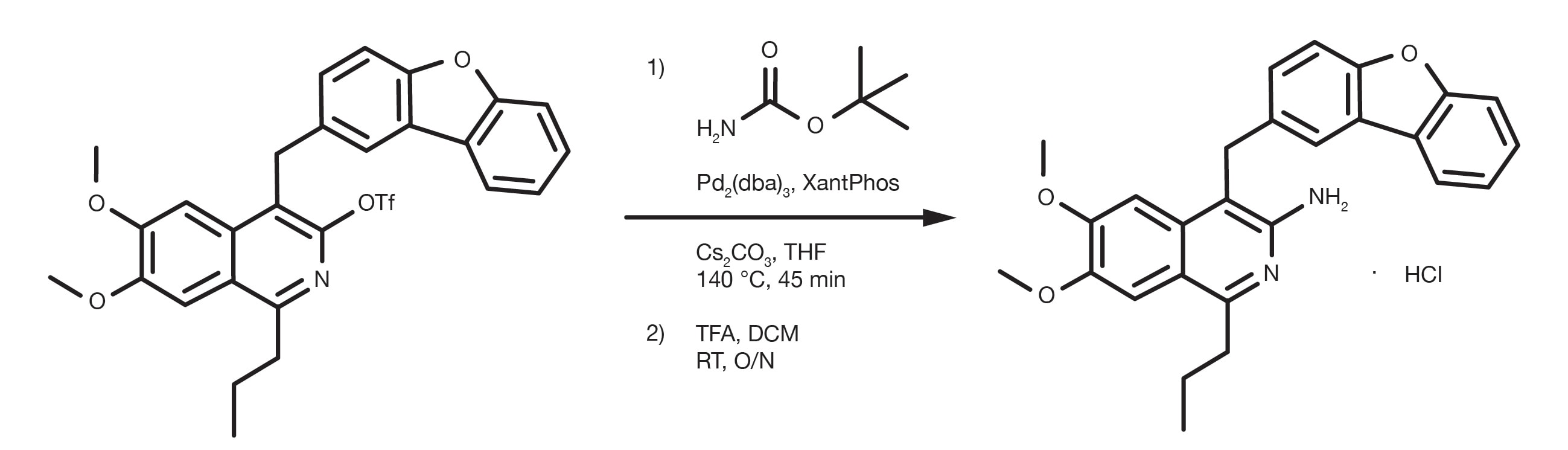
Patentreferenz: WO2012112946
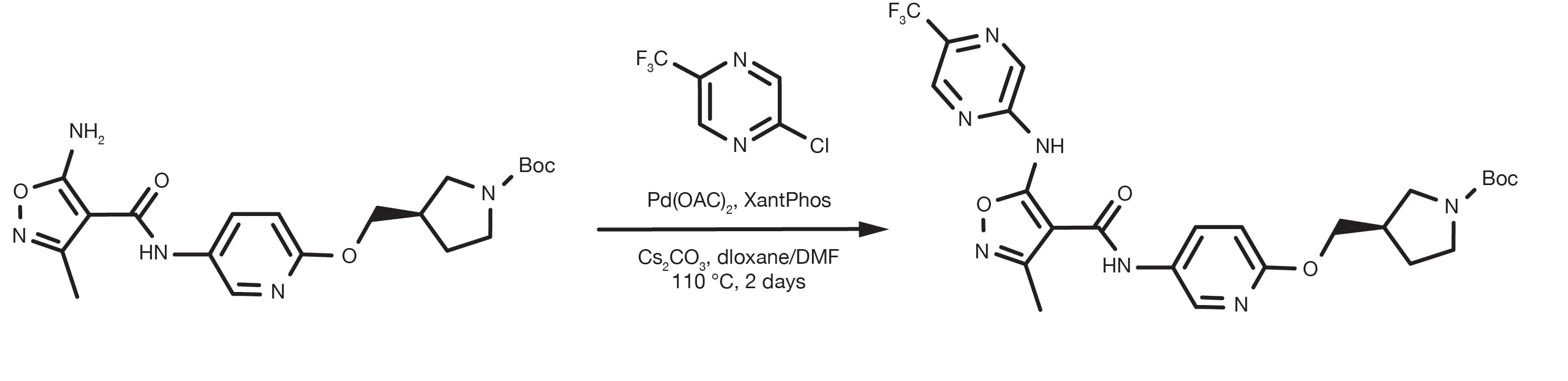
Patentreferenz: WO2016012477
Relevante Literaturhinweise:
- J. Am. Chem. Soc., 1994, 116 (13), pp 5969–5970 DOI: 10.1021/ja00092a058
- J. Am. Chem. Soc., 1994, 116 (17), pp 7901–7902 DOI: 10.1021/ja00096a059
- Journal of Organometallic Chemistry 1999, 576, pp 125-146 https://doi.org/10.1016/S0022-328X(98)01054-7
- Chem. Sci., 2011, 2, 27 DOI: 10.1039/c0sc00331j
- Angewandte Chemie 2008, 47, pp 6338-6361 https://doi.org/10.1002/anie.200800497
Produktauswahl
Bausteine:
VERWENDEN SIE DIE SUCHFUNKTION FÜR CHEMISCHE STRUKTUREN, UM DEN GEWÜNSCHTEN BAUSTEIN ZU FINDEN
Substituierte (Hetero)arylhalogenide und Triflate:
2-Chlor-5-(Trifluormethyl)pyrazin
1-Naphthyl-Trifluormethansulfonat
Primäre oder sekundäre Alkylamine:
(Hetero)Arylamine:
Andere primäre aromatische Amine
Carbamate (als Spender von Ammoniak):
Grundzutaten/Zusatzstoffe:
Lithium-bis(trimethylsilyl)amid-Lösung
Lithium-bis(trimethylsilyl)amid, fest
Katalysatoren/Liganden:
Pd-Vorkatalysatoren:
Palladiumacetat, Pd(OAc)2 / [Pd(OAc)2]3
Bis(Dibenzylideneaceton) Palladium(0), Pd(dba)2
Tris(Dibenzylideneaceton) Dipalladium(0), Pd2(dba)3 (Alfa Aesar)
Tris(Dibenzylideneaceton) Dipalladium(0), Pd2(dba)3 (Acros Organics)
Dichlorobis(tri-o-tolylphosphin) Palladium(II), PdCl2(o-Tolyl3)
Dichloro[1,1‘-bis(Dicyclohexylphosphino) Ferrocen] Palladium(II), PdCl2 (dppf)
Liganden
1,1‘-Bis(Diphenylphosphino) Ferrocen, DPPF
Xantphos, 9-Dimethyl-4,5-bis(Diphenylphosphino)xanthen
VERWENDEN SIE DIE SUCHLEISTE OBEN AUF DER SEITE FÜR EINE GEZIELTE SUCHE NACH PRODUKTNAME ODER CAS-NUMMER
Grundzutaten / Zusatzstoffe:
Lithium-bis(trimethylsilyl)amid-Lösung
Lithium-bis(trimethylsilyl)amid-Feststoff
BENUTZEN SIE DIE SUCHLEISTE OBEN AUF DER SEITE FÜR EINE GEZIELTE SUCHE NACH PRODUKTNAME ODER FALLNUMMER.
Katalysatoren/Liganden:
Pd-Vorkatalysatoren:
Palladiumacetat, Pd(OAc)2 / [Pd(OAc)2]3
Bis(dibenzylidenaceton)palladium(0)), Pd(dba)2
Tris(dibenzylidenaceton)dipalladium(0), Pd2(dba)3 (Alfa Aesar)
Tris(dibenzylidenaceton)dipalladium(0), Pd2(dba)3 (Acros Organics)
Dichlorobis(tri-o-tolylphosphin)palladium(II), PdCl2(o-Tolyl3)
Dichlor[1,1'-bis(dicyclohexylphosphino)ferrocen]palladium(II), PdCl2 (dppf)
Ligands
1,1'-Bis(diphenylphosphino)ferrocen, DPPF